Abb. 1: So könnte man sich das Nano-Angeln an den Schnittstellen unserer Nervenzellen vorstellen…
Position Indication:
Content

Andreas Karner - Fishing for happiness - Das Glück an der Nanoangel
Investigation of oligomeric receptors using branched crosslinkers in AFM force spectroscopy
oder
Fishing for happiness - das Glück an der Nano-Angel
Andreas Karner
angefertigt an der Abteilung Applied Experimental Biophysics des Instituts für Biophysik der JKU.
Es steckt in Walnüssen, Bananen und Schokolade: Serotonin. Im Volksmund als Glückshormon bekannt, ist dieses Molekül in vielen Bereichen des menschlichen Körpers vertreten und wirkt unter anderem im Herz-Kreislaufsystem, im Magen-Darm-Trakt und nicht zuletzt in unserem Gehirn. Ein Serotoninmangel kann beispielsweise zu Depressionen und Angstzuständen führen. An den Schnittstellen unserer Nervenzellen, den Synapsen, fungiert es als chemischer Botenstoff, als sogenannter Neurotransmitter. In den Membranen der Neuronen befinden sich hochspezifische und komplexe Proteine (Serotonin-Transporter), die den Level des Glückshormons in und außerhalb der Zelle steuern und somit ein wichtiges Angriffsziel für Medikamente (Antidepressiva) sind.
Eingebettet in das österreichweite, interdisziplinäre Projekt SFB35: Transmembrane Transporters in Health and Disease unter Mitwirkung von Experten aus Medizin, Pharmakologie, Biochemie und Biophysik war es das Ziel meiner Arbeit, ein Werkzeug zur Untersuchung der Wechselwirkung von Antidepressiva mit Neurotransmitter-Transportern auf molekularer Ebene zu entwickeln.
Die Methode basiert auf der Technik der sogenannten Einzelmolekül-Kraftspektroskopie [1], die man sich vereinfacht als Angeln im Nanometer-Maßstab (1 Nanometer = 1 Millionstel Millimeter) vorstellen kann. An die Nano-Angel wird das Medikament als Köder angebracht und damit auf lebenden Zellen nach Serotonin-Transportern gefischt. Hat man ein solches Protein am Haken, kann die Interaktion quantifiziert und Aussagen über die Stabilität der Bindung getroffen werden.
Als Erweiterung dieser Technik wurden im Rahmen dieses Projekts nun zwei Köder im geeigneten Abstand an der Angelschnur befestigt [2]. Damit sind nicht nur Informationen zur Wechselwirkung von Medikament und Zielprotein zugänglich, sondern gleichzeitig auch Hinweise zur räumlichen Organisation des Transporters in der Zellmembran!
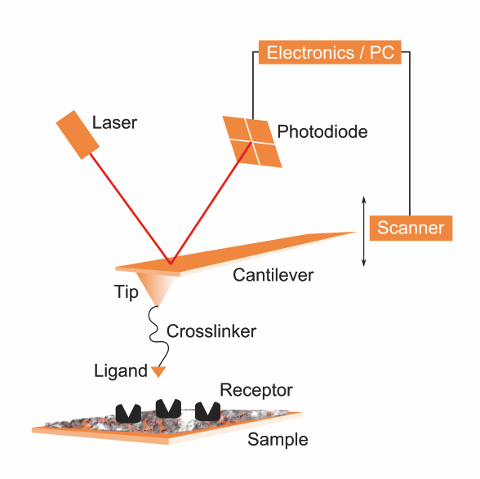
Abb. 2: Eine schematische Darstellung des Aufbaus einer Nano-Angel. Der Köder (Ligand) wird über eine Angelschnur (Crosslinker) mit der Angel (Cantilever + Tip = Krag'balken' + Spitze) verbunden. Damit kann nach Beute (Receptor) geangelt werden. Die restlichen Bauteile dienen zur genauen Positionierung der Angel im Nanometer-Maßstab, sowie zur Messung der Kräfte zwischen Köder und Beute.
Bevor dieses Werkzeug aber tatsächlich eingesetzt werden konnte, war ein langer Weg der Vorbereitung notwendig. Die Kernfrage war folgende: Wie verhalten sich die beiden Köder an der Nano-Angel, wenn sie mit einem Transporter in der Zellmembran interagieren? Um mehr darüber zu lernen wurde die Nano-Angel zunächst an einem Modell-System getestet. Die Wahl fiel dabei auf das Avidin-Biotin-System [1]: Avidin ist ein Protein aus dem Hühnereiweiß, das bis zu vier Biotin-Moleküle (Vitamin B7) mit hoher Spezifizität und Affinität binden kann. Es wurden zwei Biotin-Moleküle an die Angel gehängt und damit nach Avidin gefischt. Die Daten lieferten Informationen über das physikalische Verhalten und den Einfluss von bestimmten Parametern, wie z.B. Zeit, oder Abstand der beiden Köder an der Nano-Angel. Einen besonderen Stellenwert hatte dabei die Auswertung der Messdaten, wobei diese gruppiert wurden nach Interaktionen von einem bzw. zwei Ködern mit der Beute (siehe Abb.3). Die Verwendung von theoretischen Modellen erlaubte es, Vorhersagen zu treffen und die Eigenschaften möglichst exakt zu charakterisieren.
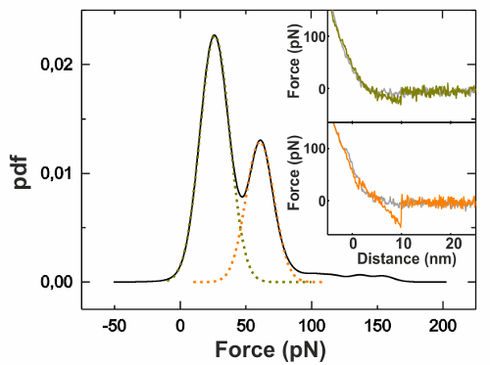
Abb. 3: Ein typisches Ergebnis meiner Messungen: Der Graph zeigt die Verteilung der Kräfte, die mit der Nano-Angel zwischen Köder und Beute gemessen wurden. Der linke ‚Berg‘ (grün) repräsentiert die Wechselwirkung von einem, der rechte ‚Berg‘ (orange) die Wechselwirkung von zwei Ködern mit der Beute.
Meine Arbeit in der Abteilung für angewandte experimentelle Biophysik bestand aus zwei Teilen: Erstens konnte ich eine vielseitig einsetzbare Methode zur Messung und Analyse von molekularen Wechselwirkungen entwickeln und testen. Im zweiten Teil gelang es mir diese Technik auf ein biologisches System anzuwenden. Ich erforschte und quantifizierte die Wirkung eines Medikaments auf Serotonin-Transporter und konnte außerdem zeigen, dass diese Transporter nicht als ‚Einzelgänger‘ (Monomer), sondern zumindest als ‚Duo‘ (Dimer) funktionieren.
Darüber hinaus sind zahlreiche Erweiterungen in diesem modularen System denkbar. Anstatt mit zwei könnte man zum Beispiel sogar mit vier Ködern gleichzeitig fischen, oder in einem weiteren Schritt auch verschiedene Köder an eine Angelschnur hängen.
[1] M. Köhler, A. Karner, M. Leitner, V.P. Hytönen, M. Kulomaa, P. Hinterdorfer, A. Ebner: pH-dependent Deformations of the Energy Landscape of Avidin-like Proteins Investigated by Single Molecule Force Spectroscopy, Molecules 2014, 19, 12531-12546
[2] D. Sinwel, A. Karner, A. Ebner, R. Zhu, P. Hinterdorfer, H.J. Gruber: Novel Generation of Crosslinkers allows Single Molecule Force Spectroscopy on Oligomeric Receptors, Biophysical Journal 2014, 106, 2, 387a


 Audit hochschule und familie
Audit hochschule und familie