Abb. 1: Farbenfrohe Beispiele für die beeindruckenden Eigenschaften metallischer Nanostrukturen. Links: Kathedrale Notre Dame de Paris (Paris, Frankreich) Mitte: Nasir-ol-Molk Moschee (Schiras, Iran) Rechts: Sagrada Familia (Barcelona, Spanien)
Position Indication:
Content

Bernhard Steinhauser – Wenn Gold rostet – ein Versteckspiel mit Potential
Plasmonics got potential - Optical sensing of gold oxidation
oder
Wenn Gold rostet – ein Versteckspiel mit Potential
Bernhard Steinhauser
angefertigt am Instituts für Angewandte Physik der JKU
|
Kurzfassung PDF |
Präsentation (PDF) |
UV blockende Sonnencremes, selbstreinigende Waschbecken und eine zur Gänze entleerbare Ketchupflasche. Dies alles sind Vertreter einer Technologie die sich die bemerkenswerte Physik der Nanowelt zu Nutze macht. Während Waschbecken und Ketchupflasche mechanische Eigenschaften nutzen, filtern in Sonnencremes millionstel Millimeter große Teilchen die krebserregende UV-Strahlung.
Eine seit der Antike genutzte Gruppe optischer Nanomaterialien sind Edelmetallnanostrukturen. Während ihre chemische Inaktivität einerseits eine natürliche Stabilität gegen Umwelteinflüsse bietet, erlaubt ihre elektrische Leitfähigkeit die Ausbildung von außergewöhnlichen optischen Eigenschaften über den gesamten sichtbaren Spektralbereich. Beeindruckende Beispiele zu den optischen Eigenschaften liefern farbige Glasfenster, die man oft in Sakralbauten findet.
Die optisch sichtbare Elektronenschwingung
Durch Wechselwirkung mit Licht werden in Edelmetallnanostrukturen Elektronen zur Schwingung mit einer bestimmten Frequenz gezwungen. Diese Elektronenschwingung wird als „Plasmon" bezeichnet. Die Resonanzfrequenz des Plasmons kann durch die Wahl von Form, Größe und Material über den gesamten sichtbaren Spektralbereich eingestellt werden. Wird ein Plasmon durch Licht angeregt, fehlen ebenjene spektralen Anteile im transmittierten Lichtstrahl die mit der Frequenz der Elektronenschwingung übereinstimmen. Mit anderen Worten, eine Farbe wird aus dem sichtbaren Spektrum gefiltert.
Im Rahmen meiner Masterarbeit am Institut für Angewandte Physik untersuchte ich die Änderungen der optischen Eigenschaften von Gold-Nanodrähten in Abhängigkeit einer äußeren Spannung. Diese Technik wird als „Plasmonvoltammetrie" bezeichnet. Durch Anlegen einer äußeren Spannung konnte ich in verschiedenen Elektrolytlösungen sowohl die elektronische Struktur des Golds als auch die unmittelbare Umgebung der Nanodrähte kontrollieren, und die optische Antwort darauf untersuchen. Es war mir außerdem möglich, diese Methode zu nutzen um die Korrosion von Gold optisch zu untersuchen.
Winzige Drähte
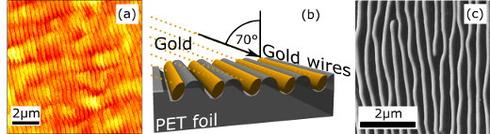
Zur Herstellung von winzigsten Golddrähten wurde eine nanostrukturierte PET-Folie als Substrat verwendet. Bestrahlt man eine Polymerfolie mit extrem intensiver Laserstrahlung, kann sich durch Materialabtrag eine Struktur aus regelmäßigen Hügeln und Tälern bilden. Bedampft man die nanostrukturierte Folie unter einem bestimmten Winkel mit Gold, bilden sich ca. 100-150 nm dicke Nanodrähte. Die Plasmonresonanz dieser Nanodrähte liegt bei einer Wellenlänge von ca. 780 nm, was am äußeren roten Ende des sichtbaren Spektralbereichs liegt.
Abb. 2: Herstellung von Goldnanodrähten[1]. (a) Rasterkraftmikroskopaufnahme der nanostrukturierten PET-Folie. (b) Aufdampfen von Gold unter einem Winkel von 70°. (c) Fertige Nanodrähte im Elektronenmikroskop.
An die Nanodrähte wird nun in einer elektrochemischen Zelle eine Dreiecksspannung angelegt. Abhängig vom verwendeten Elektrolyten können verschiedene elektrochemische Reaktionen, durch die parallele Messung des elektrischen Stroms beobachtet werden.
Elektrisch induzierte chemische Reaktionen
Durch das Anlegen einer externen Spannung wird an der Gold-Elektrolyt Grenzfläche ein gerichtetes elektrisches Feld erzeugt. Dieses elektrische Feld erzeugt an der Grenzfläche eine Anordnung der im Elektrolyten befindlichen Ionen. So werden z.B. bei positiver Ladung der Goldelektrode, negativ geladene Ionen (z.B. Hydroxidionen) angezogen.
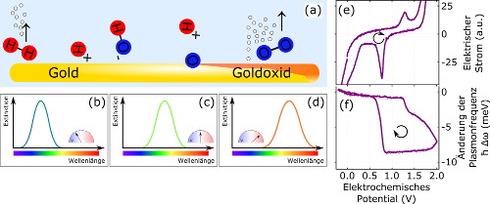
Ist die Potentialdifferenz groß genug, kann es zur Oxidation der Goldelektrode kommen (Oxidationspotential). Oxidationsprozesse lassen sich i.A. durch einen erhöhten elektrischen Strom durch die elektrochemische Zelle detektieren. Auf einer atomaren Skala bedeutet dies für Gold, dass die Sauerstoffatome in den Hydroxidionen durch die externe Spannung so stark angezogen werden, dass sie in die kristalline Goldoberfläche eingebaut werden. Es zeigt sich, dass Goldoxidation ein zweistufiger Prozess ist. Während sich zuerst nur an der Oberfläche eine dünne Oxidschicht bildet, die die restliche Elektrode schützt, dringt das Oxid bei weiterer Potentialerhöhung immer weiter ins Volumen ein. Eine schematische Darstellung der stattfindenden Prozesse ist in Abb.3(a) gezeigt.
Wie wir aus Alltagsbeobachtungen wissen, zeichnet sich Gold durch seine hohe chemische Stabilität aus. Eine direkte Konsequenz aus der hohen chemischen Stabilität ist, dass das Oxidationspotential im Vergleich zu anderen Materialien „sehr hoch“ ist. „Sehr hoch“ bedeutet, dass der zweite Oxidationprozess bei Potentialen geschieht, bei denen es zur Zersetzung von Wasser kommt. Da dies bedeutet, dass kontinuierlich Sauerstoff- und Wasserstoffgas gebildet werden, geht dieser Prozess mit einem drastischen Anstieg des elektrischen Stroms einher. Die zweite Stufe der Goldoxidation fällt jedoch genau in diesen Spannungsbereich und wird durch diesen hohen Strom überdeckt. Dies ist der Grund, warum herkömmliche elektrochemische Methoden nur bedingt geeignet sind, die Oxidation von Gold zu untersuchen.
Elektronenschwingungen trotzen der Zersetzung
Eines der zentralen Ergebnisse meiner Masterarbeit ist, dass die Plasmonresonanz (im Gegensatz zum elektrischen Stroms) nicht bzw. vernachlässigbar auf die Bildung von Sauerstoffgas reagiert. Dies bedeutet, dass der zweite Schritt der Goldoxidation mit meiner Methode direkt beobachtet werden kann.
Im Allgemeinen kann gesagt werden, dass die Plasmonresonanz mit steigender Spannung rotverschiebt (d.h. die Elektronen schwingen langsamer, siehe Abb. 3(b)-(d)). Die beiden Oxidationprozesse machen sich als rapide auftretende Rotverschiebung bemerkbar. Man sieht (Abb. 3(f)), dass die Frequenz der Plasmonresonanz zwischen einem elektrochemischen Potential von 1.2 V und 1.4 V stark abnimmt (Rotverschiebung). Dies ist auf die erste Stufe der Goldoxidation zurückzuführen. Im elektrischen Strom lässt sich der erste Oxidationsschritt ebenfalls beobachten (Abb. 3(e)). Erhöht man die Spannung weiter, kann man im elektrischen Strom den rapiden Anstieg durch Wasserzersetzung beobachten. Die Plasmonresonanz zeigt in dem fraglichen Spannungsbereich eine moderate Rotverschiebung. Woher wissen wir also, dass diese Rotverschiebung nicht auch durch Sauerstoffbildung am Gold zustande kommt?
Abb. 3: Verschiebung der Plasmonresonanz während elektrochemischer Spannungsänderung. (a) Schematische Darstellung der Adsorptions- und Oxidationprozesse. (b)-(d) Rotverschiebung der Plasmonresonanz bei Erhöhung des Potentials. (e) Elektrischer Strom durch die elektrochemische Zelle gegen angelegtes elektrochemisches Potential. (f) Änderung der Plasmonresonanzfrequenz gegen angelegtes elektrochemisches Potential. ((e) und (f) adaptiert von [1])
Aus der Elektrodynamik weiß man, dass die Plasmonresonanz stark vom Brechungsindex des umgebenden Mediums abhängt. Bildet sich Gas an der Elektrode, verringert sich fraglos der Brechungsindex der Umgebung (Die Brechungsindizes von Wasser bzw. Sauerstoffgas sind 1.33 und 1. Bei Bildung von Sauerstoffgas an der Goldelektrode ergibt sich ein Brechungsindex der zwischen den beiden Werten liegt). Ein geringerer Brechungsindex bedingt aber laut Theorie eine Blauverschiebung der Plasmonresonanz. Die beobachtete Rotverschiebung kann also nicht durch die Änderung des Brechungsindexes aufgrund der Entwicklung von Sauerstoffgas erklärt werden. In diesem Potentialbereich findet jedoch auch die zweite Stufe der Goldoxidation statt. Die Rotverschiebung der Plasmonresonanz kann mit diesem Prozess erklärt werden und liefert Ergebnisse in einem Bereich in der die konventionelle Technik keine Aussage mehr treffen kann.
Die Ergebnisse meiner Masterarbeit deuten also darauf hin, dass die Methode geeignet ist über die Wasserzersetzung hinaus sinnvolle Ergebnisse zuliefern. Dadurch könnten in Zukunft Oxidationprozesse untersucht werden die bis jetzt hinter dieser Grenze verborgen lagen.
Referenzen
[1] Steinhauser et.al. J. Phys. Chem. C, 2018, 122 (8), pp 4565–4571
Fotos
- Kathedrale Notre Dame de Paris (Paris, Frankreich): ( https://commons.wikimedia.org/wiki/File:Notre-Dame_internal_window.jpg – Author: WeEnterWinter)
- Nasir-ol-Molk Moschee (Schiras, Iran): (https://commons.wikimedia.org/wiki/File:%D9%85%D8%B3%D8%AC%D8%AF_%D9%86%D8%B5%DB%8C%D8%B1%D8%A7%D9%84%D9%85%D9%84%DA%A9_%D8%AF%D8%B1_%D8%B4%DB%8C%D8%B1%D8%A7%D8%B2.jpg – Author: Hesam.montazeri)
- Sagrada Familia (Barcelona, Spanien): (https://commons.wikimedia.org/wiki/File:011_Sagrada_Fam%C3%ADlia,_interior,_vitrall_de_la_nau.jpg – Author: Enfo)


 Audit hochschule und familie
Audit hochschule und familie