Abb. 1: Das Beziehungsleben von Antikörpern – Eine stabile Bindung braucht Zeit.
Position Indication:
Content

Jürgen Strasser - Über das Beziehungsleben von Antikörpern
Time-evolution of epitope-paratope bonds investigated by dynamic force spectroscopy
oder
Über das Beziehungsleben von Antikörpern
Jürgen Strasser
angefertigt an der Abteilung Applied Experimental Biophysics des Instituts für Biophysik der JKU, mit Unterstützung der Center for Advanced Bioanalysis GmbH (CBL)
Unser Immunsystem ist ständig darauf bedacht, uns vor Eindringlingen zu schützen. Eine wesentliche Funktion dabei übernehmen die Antikörper in unserem Blut: Sie können sich ganz spezifisch und fest an besondere Regionen auf der Oberfläche von Krankheitserregern wie Bakterien oder Viren binden. Diese speziellen Bereiche nennt man Epitope.
Ein simpler Prozess – oder steckt doch mehr dahinter?
Jüngste Studien haben gezeigt, dass die Antikörper nicht einfach still sitzen bleiben, wenn sie einmal ein Epitop gefunden haben, sondern quasi „wandern“, indem sie von einem Bindungspartner zum nächsten springen [1].
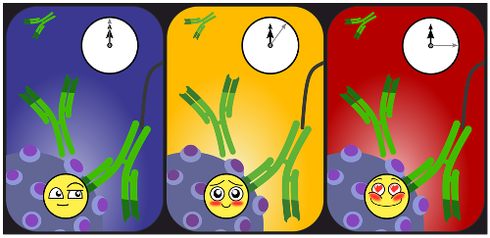
Abb. 2: Der Anstoß für meine Arbeit – Antikörper „laufen“ auf mit Epitopen versehenen Oberflächen [1].
Genau diese Dichotomie von fester Bindung auf der einen und Wanderlust auf der anderen Seite war der Anstoß für meine Masterarbeit. Ich untersuchte die Stabilität von Antikörper-Epitop Bindungen mithilfe der Einzelmolekül-Kraftspektroskopie.
Dabei wird der Antikörper auf den Nanometer (ein Milliardstel eines Meters!) genau an ein isoliertes Ziel angenähert, sodass sich die beiden Partner treffen und miteinander interagieren können. Bei diesen Experimenten kann nun der Antikörper nicht „wandern“, denn auf unseren speziell so präparierten Oberflächen ist kein anderer Bindungspartner für ihn in der Nähe. Zieht man dann an dem Paar bis es wieder auseinander geht, kann man aus der dafür nötigen Kraft Informationen über die Bindungsstabilität gewinnen (Details zum Clou meiner Messungen stehen unter Abb.3).
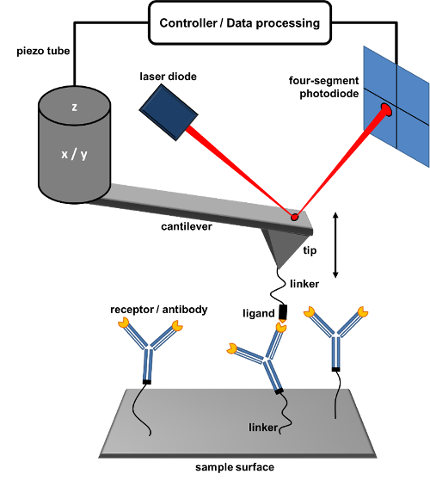
Abb. 3: Schema der Einzelmolekül-Kraftspektroskopie mit dem Rasterkraftmikroskop (englisch „AFM – Atomic Force Microscope“).Im gezeigten Aufbau wird das Epitop über eine flexible Verbindungsschnur (englisch „linker“) an den Biegebalken (englisch „cantilever + tip“) gebunden und kontrolliert an einen Antikörper auf der Probe angenähert. Treffen sich die beiden, kann eine Bindung entstehen. Wird dann am Linker gezogen bis sich diese Bindung wieder löst, kann mit dem Rest des Aufbaus sehr genau gemessen werden, wie stark die Antikörper-Epitop Wechselwirkung war. Der Clou bei meinen Messungen: Wenn man kurz wartet bevor am Linker gezogen wird, und diese „Verweilzeit“ bei vielen Tausenden Messungen variiert, kann man herausfinden, wie sich die Wechselwirkung zwischen den Bindungspartnern mit der Zeit ändert.
Die Idee: Vielleicht spielt ja die Dauer der Beziehung eine Rolle für deren Robustheit?
Tatsächlich zeigte sich, dass die Bindung stabiler wird, wenn Antikörper und Epitop mehr Zeit miteinander verbringen können.
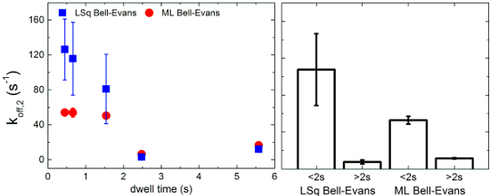
Abb.4: Ein Ergebnis meiner Arbeit: Die beiden Graphen zeigen koff, die „Trennungsrate“ von Antikörper und Epitop. Je höher diese Rate ist, desto instabiler ist die Beziehung. Nach zwei Sekunden Verweilzeit im Experiment ist koff viel kleiner als bei kürzeren Kontakten. Dies zeigt, dass die Wechselwirkung stabiler wird. Die Beziehungen „reifen“.
Diese Erkenntnis ermöglicht nun auch nähere Überlegungen zum Wanderverhalten. Diejenige Zeit, die ein wandernder Antikörper bei einem Partner bleibt, ist nämlich viel kürzer als jene, die benötigt würde, um von einer ersten Bindung zu einer festen Beziehung überzugehen [1]. Solange der Antikörper also mehrere Partner zur Auswahl hat, bleibt es bei vielen kurzen Bekanntschaften.
Ausgerüstet mit diesem Wissen über die Korrelation zwischen Kontaktzeit und Bindungsstärke sowie darüber, wie sich das Wandern von Antikörpern auf die Immunreaktion auswirkt, könnten in Zukunft gezielt effektivere therapeutische Antikörper entwickelt und angewendet werden.
Referenzen:
[1] J. Preiner, N. Kodera, J. Tang, A. Ebner, M. Brameshuber, D. Blaas, N. Gelbmann, H. J. Gruber, T. Ando, and P. Hinterdorfer, “IgGs are made for walking on bacterial and viral surfaces,” Nat. Commun., vol. 5, p. 4394, 2014.


 Audit hochschule und familie
Audit hochschule und familie